
Pentru a afla cum să faci testul, înregistrează-te pe eduboom!
Înregistrează-te Ești înregistrat? Întră în cont » .
Unde am notat cu
.
Unde am notat cu  - masa dizolvatului,
- masa dizolvatului,  - masa soluției,
- masa soluției,  - masa apa,
- masa apa, 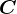 - concentrația procentuală.
- concentrația procentuală. unde
unde  - masa substanței,
- masa substanței,  - numărul de moli,
- numărul de moli,  masa moleculară.
masa moleculară. soluție de concentrație
soluție de concentrație  se află dizolvate
se află dizolvate  de substanță?
de substanță? în
în  . Ce concentrație procentuală are soluția obținută?
. Ce concentrație procentuală are soluția obținută? 
 s-au dizolvat
s-au dizolvat  hidroxid de sodiu
hidroxid de sodiu  știind concentrația procentuală a soluției
știind concentrația procentuală a soluției  ?
? 
 și acid sulfuric
și acid sulfuric  :
:

 în
în  . Soluția obținută reacționează cu azotat de argint
. Soluția obținută reacționează cu azotat de argint  .
. în
în  . Soluția obținută reacționează cu azotat de argint
. Soluția obținută reacționează cu azotat de argint  . Calculează numărul de moli de
. Calculează numărul de moli de  care a reacționat complet cu soluția precizată.
care a reacționat complet cu soluția precizată. se dizolvă în
se dizolvă în  . Soluția obținută reacționează cu fierul
. Soluția obținută reacționează cu fierul 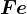 . Calculați:
. Calculați:

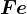 care a reacționat complet cu soluția de acid clorhidric
care a reacționat complet cu soluția de acid clorhidric 

 se dizolvă în
se dizolvă în  . Soluția obținută reacționează cu fierul
. Soluția obținută reacționează cu fierul 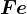 . Calculați numărul de molecule de hidrogen
. Calculați numărul de molecule de hidrogen  care se formează în urma reacției.
care se formează în urma reacției.

 soluție sulfat de cupru
soluție sulfat de cupru  , de concentrație
, de concentrație  , reacționează cu fierul
, reacționează cu fierul 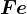 . Aflați masa de sulfat de fier, în grame, formată în urma reacției.
. Aflați masa de sulfat de fier, în grame, formată în urma reacției. 
 soluție sulfat de cupru
soluție sulfat de cupru  , de concentrație
, de concentrație  , reacționează cu fierul
, reacționează cu fierul 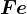 . Aflați numărul de atomi de cupru
. Aflați numărul de atomi de cupru  formați în urma reacției totale.
formați în urma reacției totale. 
Descrierea testului
Acest test corespunde lecției video Calcule chimice pe baza concentrației procentuale de masa. Partea II și este în conformitate cu programa școlară de chimie pentru clasa a VIII-a. În acest îți propun exerciții de calcul a concentrației procentuale, cantității dintr-un reactant sau produs de reacție când se cunosc date despre celălalt reactant. Pentru rezolvarea acestui test ai nevoie de o foaie de hârtie și un instrument de scris. Succes!
Pentru a comenta acest test, fii parte din eduboom!